O carbono é um elemento químico de número atômico igual a 6, o que significa que os átomos que o formam possuem seis prótons em seu núcleo. Sem dúvida este é um elemento químico extremamente importante, por ser indispensável à existência da vida. Então, por esse motivo a química orgânica estuda os principais compostos derivados do carbono. Além disso, sua massa molar é de 12,011 g/mol. O elemento químico carbono é representado pela letra C.
Certamente, na natureza são encontrados três isótopos do carbono, que são: o C-12, C-13 e C-14. O C-12 possui seis prótons e seis nêutrons no núcleo e é o mais abundante. A saber que o C-12 possui seis prótons e seis nêutrons no núcleo e é o mais abundante. Já o C-13 possui sete nêutrons e é o menos abundante. O C-14 possui oito nêutrons e é um elemento radioativo.
O carbono é um composto tetravalente, ou seja, precisa de mais quatro prótons na sua camada de valência (camada mais externa). Além de fazer quatro ligações covalentes. Podendo ser simples, duplas ou triplas e resultam na formação de milhões de compostos diferentes.
Características

O carbono realiza alotropia, formando substâncias simples. Isto é, substâncias que são formadas somente por ligações entre átomos de carbono. Existem pelo menos sete alótropos do carbono, que são grafite (alfa e beta), diamante, lonsdaleíta (diamante hexagonal), caoíta, carbono (VI) e os fulerenos. Entretanto, entre esses alótropos apenas o diamante e o grafite são naturais.
Inegavelmente, em todas as sua formas alotrópicas, o carbono esta sempre em estado físico sólido. Entretanto, outras características físicas variam de estrutura para estrutura. Por exemplo a cor, no diamante é transparente enquanto no carbono grafite é preto. Inegavelmente, o grafite é um ótimo condutor elétrico. Entretanto, não encontramos essa mesma propriedade no carbono diamante. Em contrapartida, o carbono diamante tem uma longa durabilidade, enquanto o grafite não.
Assim, o carbono está presente em tudo ao nosso redor e dentro de nós. Pois ele compõe compostos orgânicos naturais como os combustíveis fósseis. Além de também formar compostos orgânicos sintéticos, como fibras sintéticas que formam os tecidos, os medicamentos.
Esse elemento está dentro de nós dos animais e dos vegetais. Pois forma compostos importantíssimos, para exemplificar podemos citar os carboidratos, como o açúcar, a glicose e a celulose. Além das proteínas que formam o DNA, e que junto aos lipídios formam as membranas dos glóbulos vermelhos e dos glóbulos brancos. Entretanto, também pode ser associado a aspectos negativos, como a intensificação do efeito estufa e o consequente aquecimento global. Pois, o principal vilão desses problemas é o seu composto gás carbônico (CO2).
Acetilenos, o que são? Aplicação, formas de obtenção e exemplos
×Onde é encontrado

Inegavelmente, esse elemento pode ser encontrado em diferentes formas. Entre as formas alotrópicas do carbono, as mais conhecidas são o grafite e o diamante. Além disso, ele pode estar ligado a outros elementos químicos, formados diversos compostos. Por exemplo, quando ligado a dois átomos de oxigênio, forma a molécula do gás carbônico, CO2. Certamente, essa molécula é essencial na fotossíntese das plantas e na respiração celular.
Normalmente a maior parte do carbono presente na natureza está na forma de compostos, principalmente nos compostos orgânicos que apresentam o esqueleto de suas cadeias compostas por este elemento. O carbono é tão essencial para existência de vida que o DNA, as proteínas e outros compostos importantes para a vida são formados por cadeias carbônicas. Além de outros compostos amplamente estudados pela bioquímica.
A saber que a Química Orgânica é o ramo da química que se ocupa exclusivamente do estudo desse elemento e de seus compostos. Assim, acaba sendo objeto de estudo em diversas pesquisas.
Ligações de carbono

Foi descoberto na antiguidade, a sua união com outros elementos através da ligação covalente para formação de compostos e moléculas. Ou seja, a partir da ligação covalente, ele compartilha seus elétrons com os demais elementos ligando-se tetraedricamente com os quais tem afinidade eletrônica.
Esse elemento realiza quatro ligações covalentes com átomos, ou seja, é um composto tetravalente. Para exemplificar podemos citar o o gás metano. Pois o átomo de carbono está ligado a quatro átomos de hidrogênio, resultando na formula molecular CH4. Assim, as quatro ligações do carbono podem apresentar-se na forma simples, duplas ou triplas ligações, como mostramos a seguir:
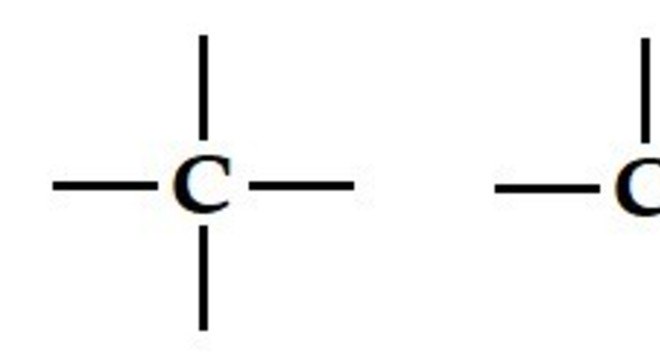
A saber que esse elemento é capaz de formar diversas cadeias carbônicas, possibilitando a criação de diversos compostos. Para exemplificar, podemos citar o caso dos combustíveis derivados de petróleo, formados, em sua maioria, por átomos de carbono e hidrogênio.
Uso Industrial do Carbono

O principal uso desse elemento pelo homem é no aproveitamento dos combustíveis fósseis, como petróleo e gás natural, compostos de hidrocarbonetos.
Por meio da destilação nas refinarias, o petróleo irá gerar gasolinas, querosene, óleos e bem como a matéria-prima para a obtenção de plásticos, enquanto o gás será usado para gerar energia elétrica de forma mais limpa.
Ciclo do carbono
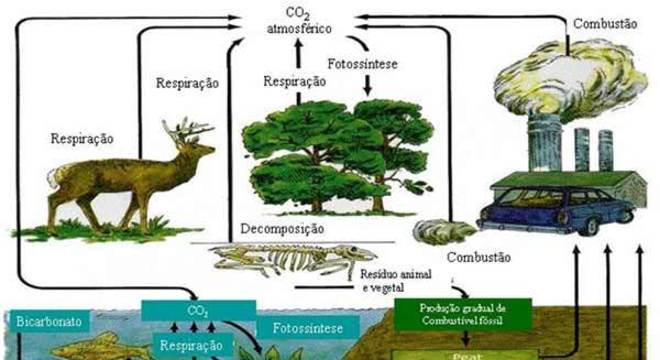
O ciclo do carbono tem início nas plantas e nos organismos que absorvem o gás carbônico disponível na atmosfera para realizarem o processo da fotossíntese. Nesse processo, o gás carbônico é convertido em gás oxigênio e açúcar (glicose) que a planta utiliza em seu crescimento.
Quando os animais e as plantas consomem a glicose, o gás carbônico é novamente emitido na atmosfera pelo processo da respiração, deixando-o disponível para um novo processo de fotossíntese. As seguintes equações químicas representam a fotossíntese e a respiração, respectivamente:
6 CO2 + 6 H2O + luz solar → C6H12O6 + 6 O2
C6H12O6 (matéria orgânica) + 6 O2 → 6 CO2+ 6 H2O + energia
Além desse processo, a decomposição de matéria orgânica também libera CO2 na atmosfera. Assim como a atividade humana, que por meio da queima de combustível e incêndios, consumindo mais carbono que absorvendo, desregulando o ciclo e causa danos ao meio ambiente.
Utilidades do carbono

Inegavelmente, devido à grande quantidade de compostos que possuem carbono em sua constituição, a quantidade dos seus usos é enorme.
Em combustíveis, como gasolina, diesel, gás natural e carvão; Na fabricação de lápis, eletrodos e lubrificantes (na forma de grafite); Na fabricação de joias e, por conta da sua dureza, em instrumentos industriais de corte, perfuração etc.; Em indústrias siderúrgicas (é adicionado à liga de ferro para dar maior resistência ao material, como é o exemplo do aço); Na datação de objetos encontrados em sítios arqueológicos (como isótopo radioativo do carbono, C-14).Além dessas aplicações, esse elemento pode servir para outras várias atividades, seja em indústrias e laboratórios, seja no nosso cotidiano.
Informações importantes
Símbolo: C Massa Atômica: 12 u Número atômico: 6 Ponto de Fusão: 3550°C Ponto de Ebulição:4289°C Formas alotrópicas: Diamante e grafite. Configuração Eletrônica: 1s², 2s², 2p²Curiosidades
Por ser um dos elementos mais versáteis, ele possui algumas singularidades:
Cerca de 20% da massa do corpo humano são constituídos desse elemento; São conhecidos mais compostos que possuem carbono em sua composição do que os que não o possuem; Esse elemento é o quarto elemento mais abundante no Universo; O material de maior dureza é o diamante, constituído exclusivamente desse elemento; O isótopo do carbono C-12 é utilizado para calcular as massas atômicas dos outros elementos químicos.Por fim, leia também sobre o Concentração de soluções – O que é, tipos e conceitos.
Fonte: Brasil escola, Infoescola, Toda matéria.
Imagem de destaque: Guia do estudo
Essa matéria Carbono, o que é? Características, onde é encontrado e ligações foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários