A hidroxila (ou oxidrila) é uma molécula de água com déficit de um átomo de hidrogênio. Com isso, decorrente da característica de grande eletronegatividade do oxigênio, sobretudo se comparado ao hidrogênio, é possível dizer que neste processo ele perde o único elétron de sua eletrosfera. Dessa forma, o oxigênio adquire excesso de elétrons na sua camada de valência e confere ao íon carga negativa (OH–). Apesar de parecer complicado, é um processo visto em ações diárias e suas relações podem ser facilmente encontradas na química orgânica.
Esse processo está presente nas bases de Arrhenius; assim como, na química orgânica por fazer parte do grupo carboxila e ser responsável pela definição dos fenóis e alcoóis.
Desse modo, para entender todo esse processo, hoje vamos falar sobre as relações de hidroxila.
Bases de Arrhenius e a relação com a hidroxila
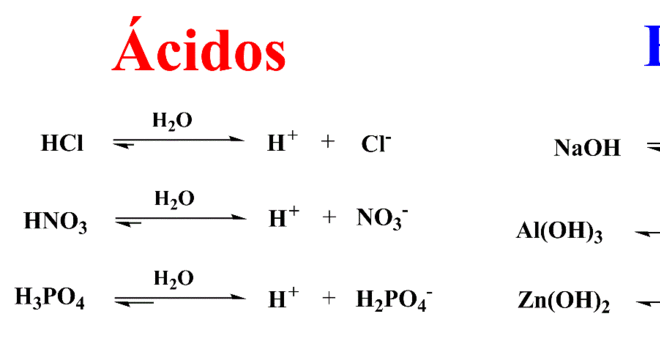
Para a teoria de Arrhenius, base é a substância que aumenta a concentração de íons hidroxila (OH–) pela sua dissociação em meio aquoso. Desse modo, é responsável por aumentar o pH do meio e diminuir, por consequência, o pOH. Assim, possui sabor adstringente e reage com ácidos de Arrhenius formando um sal e água.
As bases de Arrhenius seguem determinadas classificações que dependem do número de hidroxilas ligadas ao átomo central. Sendo assim:
Quanto ao número de OH– da molécula temos:
Monobases: KOH, NaOH, LiOH; Dibases: Mg(OH)2, Ca(OH)2, Ba(OH)2; Tribases: Al(OH)3, Fe(OH)3; Tetrabases: Sn(OH)4, Pb(OH)4;Quanto à força (capacidade de dissociação):
Fortes: hidróxidos de metais das famílias 1A e 2A. Hidróxidos de berílio e magnésio são excludentes; Fracas: Os demais hidróxidos metálicos e de amônio (NH4OH);Quanto à solubilidade (meio aquoso);
Solúveis: Hidróxidos da família 1A e o hidróxido de amônio; Pouco solúveis: Hidróxidos da família 2A, em geral; Insolúveis: Os demais.Oxigênio, o que é? Definição, principais características e utilização
×Ácidos Orgânicos
Os ácidos orgânicos podem ser caracterizados pela presença do grupo carboxila (COOH) e algum radical orgânico. Assim, eles seguem a teoria de Arrhenius, a qual os ácidos liberam H+ em meio aquoso, a saber, esse processo ocorre mesmo com ácidos considerados mais fracos.
Contudo, é importante observar que ao contrário dos ácidos inorgânicos, neste processo, o cátion de hidrogênio que é liberado não pertence ao átomo central, mas sim à hidroxila da molécula. Nesse sentido, quando há a incidência de dois átomos de oxigênio, o escape do próton na presença de água se torna mais evidente.
Alcoóis
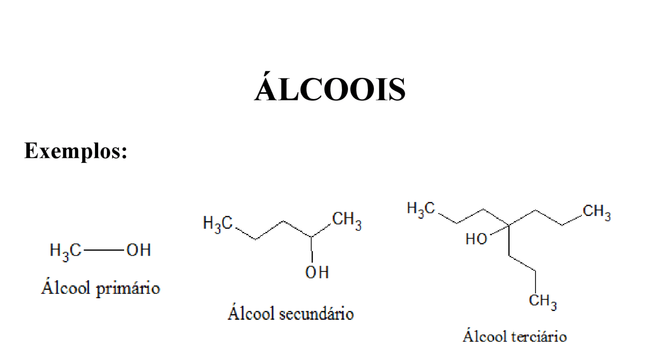
Os alcoóis podem ser definidos como substâncias ou compostos orgânicos que tem o grupo hidroxila (OH) interligado a um ou mais átomos de carbonos saturados. Desse modo, vale acrescentar que os álcoois possuem várias características que contribuem para a sua diferenciação entre outras substâncias. Vejamos um pouco mais sobre isso:
Nomenclatura
Sua nomenclatura segue a regra da União Internacional de Química Pura e Aplicada (IUPAC). Assim, são sempre formados por prefixo, uma palavra intermediária e um sufixo, respeitando a seguinte forma:
prefixo – corresponde ao número de carbonos: 1 met, 2 et, 3 prop, 4 but, 5 pemt, 6 hex, 7 hept, 8 oct, 9 non, 10 dec. intermédio – indica o tipo de ligação química: an ligações simples, dien 2 duplas , in 1 tripla, diin 2 triplas, enin 1 dupla e 1 tripla. sufixo – corresponde a função orgânica, tendo o ol como indicativo de sufixo.Exemplos de Álcoois e Aplicações
Certamente você já ouviu falar sobre os álcoois do tipo etanol e metanol, afinal, são os exemplos de àlcoois mais conhecidos e fáceis de serem encontrados. Vejamos um pouco sobre eles:
EtanolO etanol ou álcool etílico(CH3CH2OH), é o tipo de álcool utilizado nas bebidas alcoólicas e nos combustíveis. Assim, pode ser obtido a partir do processamento e fermentação de cana de açúcar, milho, beterraba e batata, dentre outros. Hoje, o etanol é um dos principais álcoois com alto poder de crescimento socioeconômico, isso porque, além de ser uma opção mais econômica comparado a gasolina, ainda é um meio considerado mais sustentável, uma vez que não produz dióxido de enxofre (SO2), sendo, portanto, menos poluente.
Sua principal matéria-prima é a cana de açúcar e no país, sua produção é considerada a nível mundial, ficando, dessa maneira, atrás apenas dos Estados Unidos.
MetanolJá o metanol ou álcool metílico (CH3OH) é utilizado como solvente na indústria farmacêutica e também como combustível de carros de corrida. Ademais, sua composição é altamente tóxica, dessa forma, a ingestão mesmo que em pequenas quantidades, pode provocar sérios danos e levar até mesmo a morte. Melhor tomar cuidado!
Então, há também que se considerar o àlcool iodado, muito utilizado como antisséptico, igualmente, o álcool isopropílico. Há ainda, a glicerina ou glicerol, que por sua vez, é usada em produtos de cosmética. Enquanto o xiliton é um poliálcool usado como adoçante natural.
Classificação
De acordo com a posição da hidroxila, os álcoois podem ser classificados em:
Primários: ligados a apenas um átomo de carbono. Secundários: ligados a dois átomos de carbono. Terciários: ligados a três átomos de carbono.Neste sentido, com a oxidação dos álcoois primários são obtidos os aldeídos, primordialmente encontrados em flores e frutas.
Já a classificação mediante o número de hidroxilas, nos dá a seguinte denominação:
Monoálcool: possuem apenas uma hidroxila. Diálcool: possuem duas hidroxilas. Triálcool: ligados a três hidroxilas.Fenóis
São compostos orgânicos oxigenados que apresentam o grupo hidroxila (OH) ligado a um composto aromático. Neste sentido, são comumente encontrados na composição de produtos como desinfetantes, por exemplo. São, ainda, caracterizados por um anel benzênico ligado a uma ou mais hidroxilas. Apesar de possuir o mesmo grupo OH dos alcoóis, são mais ácidos devido a estrutura de ressonância das ligações, as quais estabilizam a base conjugada.
Assim, como a hidroxila é um orientador orto-para dirigente, em reações de substituição dos hidrogênios do anel fenólico, as substituições, portanto, sempre irão ocorrer nestas posições.
Contudo, se você ainda ficou com uma alguma dúvida sobre a hidroxila, só para exemplificar, não deixe de conferir o vídeo abaixo:
Por fim, gostou desse conteúdo? Se sim, você também irá gostar de ler uma matéria mais completa sobre Álcoois.
Fontes: Guia do Estudante, InfoEscola, Toda Matéria, Mundo e Educação
Imagem: Free Png. Doc Sity. Mundo da Química
Essa matéria Hidroxila, o que é? Características, aplicações e exemplos foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários