Ao longo da história, vários foram os modelos atômicos criados até chegar à estrutura que se tem conhecimento hoje. Os primeiros à demonstrarem algo relacionado a teoria atômica foram Demócrito e Leucipo, ainda em 500 a.C. Porém, naquela época, a comunidade grega não aceitou as conclusões dos filósofos. Atualmente, o modelo atômico de Schrödinger é o modelo que define a estrutura atômica.
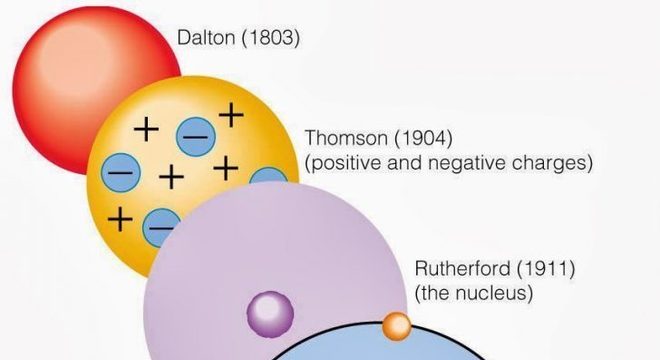
A princípio, antes de chegar ao modelo atual de como o átomo é composto, a trajetória foi longa. O primeiro a apresentar uma ideia estrutural do átomo foi John Dalton. Em seguida, outros cientistas, como Thomson, Rutherford, Bohr, também contribuíram para a ciência com seus modelos atômicos.
Nesse sentido, o entendimento sobre o que era o átomo e qual a sua formação evoluiu muito de Dalton até Schrödinger. Hoje sabe-se que o átomo é dividido em duas partes, sendo o núcleo atômico e a eletrosfera. No núcleo estão localizadas as partículas subatômicas, prótons e nêutrons. Já na eletrosfera estão os elétrons.
(adsbygoogle = window.adsbygoogle || []).push({});Modelo atômico de Schrödinger
Primeiramente, antes de chegar ao modelo atômico de Schrödinger, é preciso relembrar o que dizia o modelo atômico de Bohr. Ou seja, de acordo com Bohr, os elétrons estariam presentes na eletrosfera, girando em torno do núcleo em órbitas quantizadas. Além disso, para o físico, os elétrons estariam na eletrosfera de forma estacionária. Foi durante os estudos de Bohr que os conceitos sobre energia quântica surgiram.
A partir disso, físicos como Sommerfeld e Louis de Broglie propuseram, em 1916 e 1920, respectivamente, variáveis sobre a energia quântica e sobre a dualidade do elétron. Ou seja, o elétron assume a característica de ser “partícula–onda“, onde tem a trajetória constante elíptica, enquanto partícula. Já quando se comporta como onda, o átomo assume movimento ondulatório.
Quando Werner Heisenberg propôs o princípio da incerteza, tudo que se sabia sobre os elétrons e como essas partículas se encontravam ao redor do núcleo mudou. Com isso, ficou determinado que era impossível saber a posição e velocidade de um elétrons, de forma exata, quando estes estivessem na eletrosfera. Logo, Erwin Schrödinger colocou em pauta que daria para descrever as particularidades dos elétrons por meio da Mecânica ondulatória.
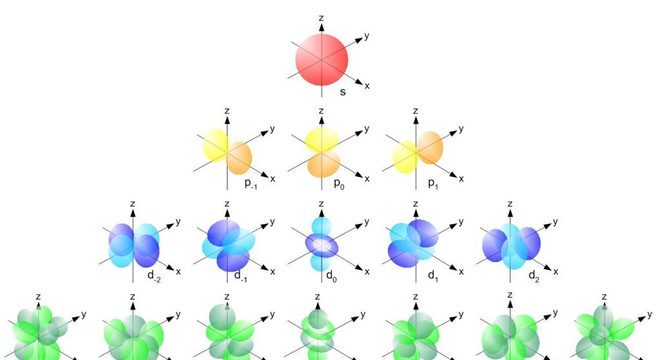
Orbitais atômicosDessa forma, após longo período de estudos e cálculos, Erwin Schrödinger determinou em que parte do espaço seria possível encontrar elétrons. A utilização do termo “órbita” já não era mais cabível, já que Heisenberg havia definido que não era possível identificar de forma exata a velocidade dos elétrons. Assim, Schrödinger chegou à conclusão que a eletrosfera era formada por orbitais atômicos.
google_ad_client = "ca-pub-1360360021251685"; google_ad_slot = "7008382253"; google_ad_width = 200; google_ad_height = 90;Schrödinger estabeleceu que, para cada nível de energia da eletrosfera, havia um orbital tridimensional. Além disso, o físico possibilitou o entendimento de como ocorre o processo de hibridação nos átomos de carbono. A partir disso, foi possível definir a geometria molecular de vários elementos químicos. Ou seja, com a geometria molecular foi possível definir as propriedades químicas e físicas dos compostos químicos.
Partículas subatômicas, o que são? Conceito, aplicação e tipos
×A equação de Schrödinger
Em síntese, a partir do entendimento dos orbitais atômicos, Schrödinger definiu que, para cada nível de energia dos elétrons, existe uma camada de valência. Conforme a camada de valência se distância do núcleo atômico, maior é a distância que o elétron se encontra do núcleo, de acordo com as camadas.
Os números quânticos, neste caso, representam subníveis de energia que são representados por letras. Os subníveis podem ser divididos em s,p,d e f e os números correspondentes aumentam conforme a ordem alfabética das letras. Veja:
Número quântico (n) = 1, l = 0 → o subnível s.
Número quântico (n)= 2, l = 0, 1 → sendo l= 1, o subnível p.
Para n = 3, l = 0, 1, 2 → sendo l = 2, o subnível d.
(adsbygoogle = window.adsbygoogle || []).push({});Para n = 4, l = 0, 1, 2, 3 → sendo l = 3, o subnível f.
A partir disso, os estudos sobre o modelo quântico foram aprofundados. Nesse sentido, os elétrons eram pensados como matéria de probabilidade, Schrödinger. Junto aos estudos desenvolvidos pelo físico, e para desenvolver os cálculos da onda-partícula, utilizou-se o comprimento de onda de Broglie e o princípio da incerteza de Heisenberg.
Dessa forma, para Schrödinger as ondas caracterizam os elétrons em modo estacionário ou em orbitais. Em ambos os casos, os elétrons ficam dispostos em diferentes níveis de energia. Assim, para calcular as prováveis regiões onde os elétrons se encontram, Schrödinger estabeleceu uma fórmula independente do tempo:
H^ψ = Eψ
Em que:
E : proporcionalidade constante.
Ψ : função de onda do sistema quântico.
Η : operador hamiltoniano.
Características do modelo atômico de Schrödinger
Dentre as principais características do atual modelo atômico podemos destacar:
Schrödinger descreveu os elétrons como partículas em movimento de ondas estacionárias; Os elétrons não possuem posição ou movimentação fixa, ou seja, se movem de maneira constante; O modelo atômico de Schrödinger definiu as prováveis regiões onde os elétrons podem ser encontrados; Por fim, as regiões destacadas por Schrödinger foram chamadas de orbitais atômicos.O que achou da matéria? Se gostou, confira também o que é Número de Massa e quais as características da Luz Visível.
Fontes: Info Escola, Portal São Francisco e Unicamp
Imagens: Ache tudo e Região, Química Ensinada e Khan Academy
(adsbygoogle = window.adsbygoogle || []).push({});Essa matéria Modelo atômico de Schrödinger – Definição e principais características foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários