Pontes de hidrogênio, também chamadas de ligações de hidrogênio, são interações intermoleculares que ocorrem entre uma molécula de hidrogênio e um átomo eletronegativo.
Alguns exemplos de átomos que participam da interação são: flúor, oxigênio e o nitrogênio.
Uma das principais características das interações intermoleculares é que a ligação só ocorre com moléculas polares. Isso porque, são moléculas que apresentam estado físico sólido e líquido.
(adsbygoogle = window.adsbygoogle || []).push({});Na Química Orgânica, por exemplo, as interações com hidrogênio são classificadas como a ligação mais forte de todas.
Ou seja, a interação apresenta alta eletropositividade – característica do hidrogênio – e alta eletronegatividade – presente em átomos, como oxigênio, flúor e nitrogênio.
Mas afinal, qual a aplicação das Pontes de Hidrogênio? Vamos descobrir!
Definição de pontes de hidrogênio
Em síntese, as pontes de hidrogênio são interações formadas por ligação covalente entre o hidrogênio e o FON – oxigênio (O), nitrogênio (N) ou flúor (F). No caso, a ligação covalente ocorre com átomos eletronegativos.
google_ad_client = "ca-pub-1360360021251685"; google_ad_slot = "7008382253"; google_ad_width = 200; google_ad_height = 90;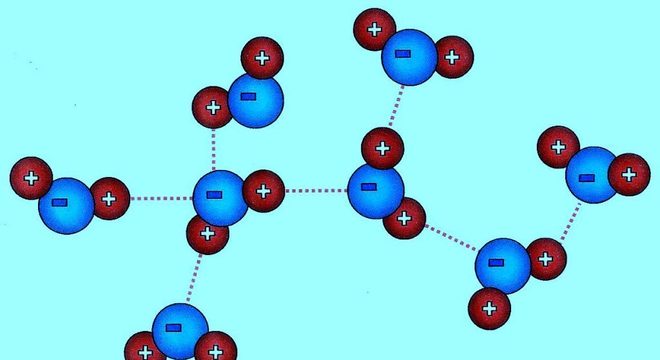
Sendo assim, a interação só é possível quando as moléculas são elementos de átomos negativos, sobretudo com tenência para atrair elétrons. Portanto, as moléculas do FON criam polos negativos, que resultam em uma carga parcialmente positiva e negativa.
Com isso, as moléculas apresentam maior probabilidade de encontrar um elétron ao redor do núcleo e, assim, interagir com todas as partículas, positivas ou negativas.
Logo, a interação entre as substâncias permite que a força seja forte o suficiente para resultar em partículas eletronegativas.
A partir da interação, os prinicipais efeitos das pontes de hidrogênio são:
Aumento do ponto de ebulição nas reações; Comportamento azeotrópico (comportamento diferente das moléculas quando submetidas à ebulição); Grande solubilidade dos sais na água; Aumento de constantes dielétricas.Alcenos, o que são? Definição, principais características e exemplos
×Características
Essa ligação tem como particularidade, promover uma rede de molécula forte, permitindo, até mesmo, que um mosquito pouse em cima dela.
(adsbygoogle = window.adsbygoogle || []).push({});Isso ocorre por causa da estrutura física entre as interações fortes, fracas, eletromagnéticas e gravitacionais em contato com as partículas.
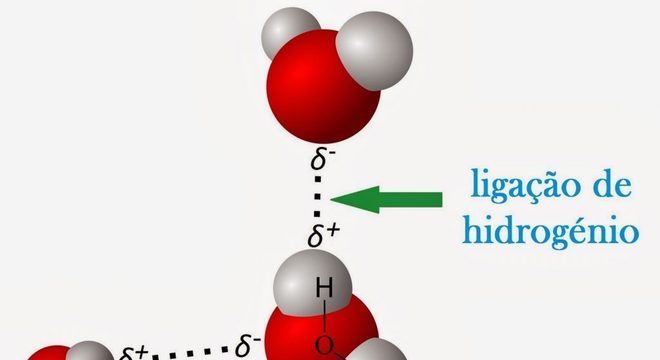
A ligação entre elas libera condições eletrônicas propícias para formarem estruturas intermoleculares estáveis.
A principal aplicação das pontes de Hidrogênio está relacionada com força de Van der Waal – quando há forças de atração e repulsão entre as moléculas.
Ou seja, quando os elétrons de um determinado átomo não acabam abruptamente no último orbital atômico preenchido, a ação permite que ocorra a interação entre o núcleo e elétrons pertencentes a outros átomos.
Aplicação das ligações de hidrogênio
As pontes de hidrogênio se desfazem e refazem facilmente, possibilitando maior interação entre os elementos. Por exemplo, a água é classificada como um dos elementos beneficiados pelo processo de interação.
Ou seja, quando o gelo flutua sobre a água, as partes hidrofóbicas se unem através das ligações de Van der Waals. Dessa forma, as partes hidrofílicas se voltam para fora, circundadas por um escudo de moléculas de água.
Neste caso, a interação ocorre por meio da ligação covalente, cuja principal característica é o compartilhamento de um par de elétrons de valência pelos átomos que formam a molécula.
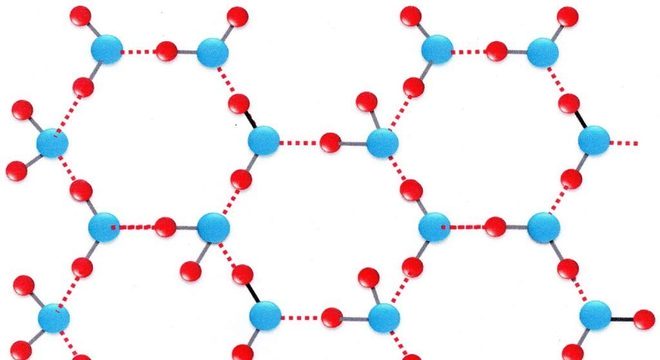
Consequentemente, a interação entre as moléculas permite que, ao encontrar um elétron ao redor do núcleo, ocorra a ligação com os demais núcleos dos átomos. Portanto, os núcleos atômicos, negativos e positivos, são aproximados pela interação.
Além disso, as interações intermoleculares estão presentes da seguinte forma:
DNA – as moléculas de DNA e RNA, por exemplo, são ligadas por meio de pontes de hidrogênio. Neste caso, ocorre a interação entre as moléculas de hidrogênio, nitrogênio e oxigênio das cadeias de nucleotídeos; Água – nas moléculas de água a ligação de hidrogênio está presente na formação de uma tensão superficial. Ou seja, isso significa que as estruturas químicas da água possibilitam a formação de pontes de hidrogênio, que resultam em uma película na superfície.E aí, o que achou de ler sobre as Pontes de Hidrogênio? Que tal conhecer mais sobre os Modelos atômicos – Definição, evolução e principais características.
Fonte: Info Escola, Stoodi e USP.
Imagem: Conceitos, Aprendendo química online e Mundo da Bioquímica.
(adsbygoogle = window.adsbygoogle || []).push({});Essa matéria Pontes de hidrogênio, o que são? Definição, características e aplicação foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários