Pela Lei de Hess se calcula a quantidade de energia que está presente nas substâncias depois que sofrem reações químicas. Isso é chamado de variação da entalpia.
Só dá para medir a variação da entalpia e não ela propriamente dita. Portanto na Lei de Hess estão a fundamentação da Termoquímica.
Se quisermos visualizar a Lei de Hess, também podemos visualizá-la por meio de um diagrama de energia. Além disso, é possível a aplicação do princípio da conservação de energia, ou seja, da 1ª Lei da Termodinâmica.
Contexto Histórico
O cientista suíço Germain Henry Hess (1802 – 1850) foi professor na Universidade de São Petersburgo, na Rússia. É considerado um pioneiro da Físico-Química, posto que estudou os calores das reações químicas.
Também analisou as relações desses calores com a conformidade entre as substâncias, assim como com as forças de ligação entre elementos químicos.
A Lei de Hess estabeleceu que a variação de entalpia na reação química se condiciona só aos estados inicial e final da reação. Essa lei obviamente é experimental, só que é também essencial ao estudo da Termoquímica.
Segundo Hess, o calor que se libera ou se absorve na reação química não depende dos estados intermediários por onde passa a reação.
Termoquímica, o que é, para que serve, reações químicas e entalpia × Aprenda a calcular a Lei de HessA variação da entalpia pode ser calculada diminuindo a entalpia inicial, aquela que antecede à reação, da entalpia final: ΔH = Hf – Hi. Há outra maneira de fazer o cálculo, posto que se usa a soma das entalpias em cada uma das reações intermediárias.
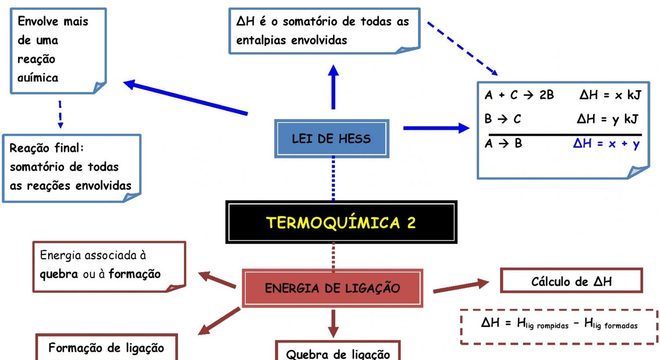
Não se considera aí nem o número nem o tipo das reações. A fórmula é: ΔH = ΔH1 + ΔH2. Aqui é um caso diferenciado de ocorrência do princípio da conservação de energia, dentro da 1ª Lei da Termodinâmica.
Tal cálculo considera tão somente os valores inicial e final. Daí se concluir que a energia intermédia não influencia no resultado da sua variação.
Outra forma de calcular a Lei de Hess é como uma equação matemática. Bastando assim inverter a reação química, inclusive também invertendo o sinal do ΔH.
Deve-se também multiplicar a equação, posto que o valor do ΔH igualmente precisa ser multiplicado. Por fim, ao dividir a equação, necessário dividir o valor do ΔH.
A utilização de uma diagramaUm diagrama de energia pode também ser utilizado para se visualizar a Lei de Hess:
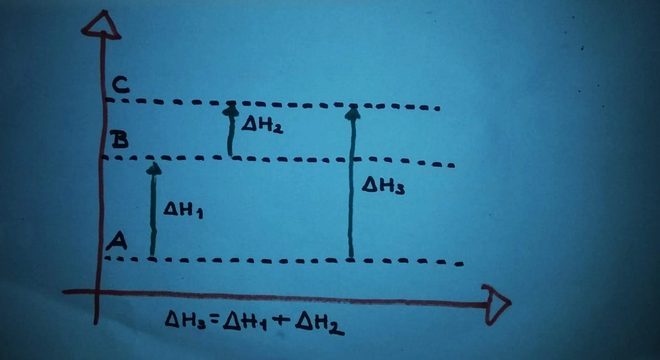
O diagrama acima demonstra os níveis de uma entalpia. Nas reações sofridas (endotérmicas) há a absorção de energia. ΔH1 significa a variação de entalpia que ocorre de A para B.
Vamos lhe dar o valor simbólico de 122 kj. ΔH2 é a variante de entalpia que se dá de B para C. A ela daremos o valor de 224 kj. ΔH3 é a variação de entalpia que ocorre de A para C.
Nossa missão é encontrar o valor de ΔH3, posto que ele equivale à variação de entalpia da reação de A para C. Vamos assim chegar ao valor de ΔH3, partindo da soma da entalpia em cada uma das reações:
ΔH3 = ΔH1 + ΔH2ΔH3 = 122 kj + 224 kjΔH3 = 346 kj. Também pode ser: ΔH = Hf – HiΔH = 346 kj – 122 kjΔH = 224 kj.
o ΔH será o mesmo se partirmos sempre de um mesmo estado inicial e se chegarmos sempre a um mesmo estado final. Isso independe se a reação for direta, assim como se se der em diversas etapas.
Leia também sobre a calorimetria, o que é e como ela estuda as trocas de calor entre corpos.
Fonte: Educação, Toda Matéria, Brasil Escola, Info Escola, Só Q, Wikipédia, Quero Bolsa, Manual da Química, Alunos Online.
Fonte das imagens: Youtube, Youtube, Descomplica, Pré Químico,
O post Lei de Hess, o que é, história, cálculo e seu fundamento na Termoquímica apareceu primeiro em Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários