O ácido sulfúrico é um ácido forte e corrosivo, também chamado ácido de bateria ou óleo de vitriolo. Ele é considerado um ácido dentro das funções inorgânicas pelo fato de possuir em sua estrutura hidrogênios ionizáveis, e porque a única parte de carga positiva em sua molécula é o cátion H+.
Ele é uma solução aquosa de sulfato de hidrogênio, cuja fórmula é H2SO4.
Sendo assim, também é importante saber que o ácido sulfúrico é uma das substâncias mais usadas pela indústria, e por isso é utilizado como indicador de potência industrial de um país.
Características do ácido sulfúrico
As principais características desse ácido é que ele é extremamente tóxico e viscoso. Sua substância é líquida e incolor, e ele também é corrosivo. Isso porque o ácido sulfúrico tem um poder oxidante e desidratante muito forte, sendo capaz de carbonizar compostos orgânicos.
É obtido a partir de enxofre, oxigênio e água através de processo de contato, e geralmente é comercializado com pureza de 97% e sua evaporação é bastante lenta na temperatura ambiente.
O grau de ionização desse ácido é muito elevado (α = 61%), o que significa que ele é um ácido forte. Ele é solúvel em solventes polares, sendo que com a água ocorre uma reação extremamente exotérmica, ou seja, libera muito calor.
Por isso, ao usar o ácido sulfúrico em laboratório, é necessário ter um imenso cuidado. Nunca pode despejar a água sobre o ácido, mas sim o processo inverso. Ao ser adicionado ácido na água, a liberação de calor é minimizada.
Além disso, possui um elevado poder oxidante e desidratante, e por essa razão, é tão perigoso. Isso porque ele pode chegar a carbonizar compostos orgânicos, como tecidos de organismos vivos.
Sendo assim, ele é um grande causador de problemas ao ser humano quando ingerido acidentalmente, ou quando é inalado ou derrubado sobre a pele.

Olfato – O que é, como funciona e distúrbios do sistema olfativo
×Fórmula do ácido sulfúrico
Seu provável descobridor foi o Jabir Ibn Hayyan e o nome do ácido sulfúrico inicialmente era Zayt al-Zaj, ou óleo de vitríolo.
Esse ácido é composto por dois átomos de hidrogênio, um de enxofre e quatro de oxigênio, resultando na fórmula molecular H2SO4. Sua fórmula estrutural é tetraédrica.
As ligações desta molécula são todas do tipo covalente polar.
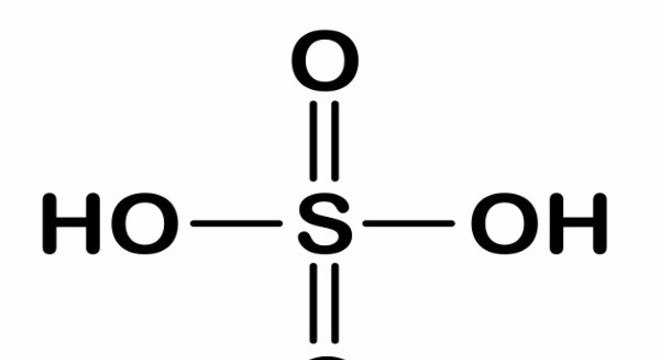
Fonte: Brasil Escola
Assim como os outros ácidos, o ácido sulfúrico é solúvel em água, liberando o íon H+, nesse caso: dois cátions. Veja na reação como fica: H2SO4(aq) → 2 H+(aq) + SO42-(aq)
Uma das formas de analisar a força dos oxiácidos, que são os que apresentam oxigênio em sua estrutura, é fazendo a subtração do número de hidrogênios ionizáveis com o número de oxigênios presentes na molécula. Se o resultado for um número igual ou maior que 2, temos um ácido forte; se o resultado for igual a 1, o ácido é moderado, e se for menor que 1 é considerado fraco.
Por exemplo, no caso do ácido sulfúrico temos a subtração:
(Número de átomos de O – Número de átomos de H)
(4-2=2)
Portanto, como o resultado é igual a 2, podemos classificar o ácido sulfúrico como forte.
Para que serve o ácido sulfúrico?
Como visto anteriormente, o ácido sulfúrico é uma substância química muito produzida e utilizada pelas indústrias.
Sendo assim, seu consumo constitui um importante indicador do desenvolvimento técnico do país. Uma de suas mais conhecidas aplicações é como solução de baterias usadas em automóveis. Geralmente a concentração dessas soluções nas baterias é de 30%, e a medição da sua densidade mostra se a bateria precisa ser carregada ou não.
Ele é usado também nas indústrias petroquímicas para o refino de petróleo e como decapante de ferro e aço.
Além disso, o ácido sulfúrico é utilizado na produção de fertilizantes e no tratamento de água. Também é usado na produção de papel e na limpeza industrial como removedor de oxidação e ferrugem.
Portanto, entre as formas de obtenção do ácido sulfúrico pela indústria, a principal utiliza três etapas:
1ª. Obtenção do dióxido de enxofre (SO2(g)) 2ª. Obtenção do trióxido de enxofre (SO3(g)) 3ª. Produção de ácido sulfúrico pela reação entre o trióxido de enxofre e água.
Fonte: Segurança e Telecom
Perigos
Devido ao seu poder corrosivo e desidratante, o ácido sulfúrico é classificado como um dos ácidos mais perigosos que existem.
Em contato com a pele, o ácido pode provocar queimaduras graves por meio de uma reação de desidratação. Desse modo, ele decompõe proteínas, carboidratos e lipídios presentes na pele e nos músculos.
Os vapores liberados pelo ácido sulfúrico também são prejudiciais, principalmente se inalados em grandes quantidades, provocando irritação dos olhos e das vias respiratórias.
Portanto, deve-se tomar muito cuidado ao manipular ácido sulfúrico e armazená-lo de forma correta: em recipiente de vidro e com a devida rotulação da sua concentração.

Fonte: Canal Área Secreta
Curiosidade
Já ouviu falar em chuva ácida?
Pois bem, o ácido sulfúrico é o principal “vilão” da chuva ácida, que destrói monumentos históricos e construções, além de degradar o meio ambiente. Isso acontece porque os combustíveis fósseis (carvão e os derivados do petróleo), possuem enxofre como impureza em suas composições.
Dessa forma, quando queimados para gerar energia, eles liberam óxidos de enxofre para a atmosfera, como o dióxido de enxofre (SO2(g)).
Sendo assim, esse óxido reage com a água da chuva e forma o ácido sulfúrico, que é um ácido forte e, por isso, causa vários estragos.
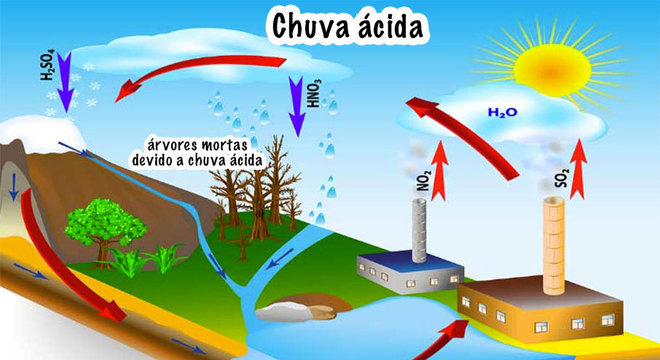
Fonte: Grupo Escolar
Agora que você entendeu tudo sobre ácido sulfúrico, entenda também sobre o ácido clorídrico.
Fontes: Brasil Escola, InfoEscola, Mundo Educação
Fonte Imagem Destaque: Manual da Química
Essa matéria Ácido Sulfúrico – Características, para que serve, perigos e curiosidade foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários