A eletrólise é um reação química não espontânea que envolve uma reação de oxirredução, a qual é provocada por uma corrente elétrica.
Sendo assim, trata-se de um processo inverso ao que ocorre nas pilhas. O processo das pilhas é espontâneo, ou seja, ao contrário da eletrólise. Isso porque na eletrólise, é necessário que se forneça a corrente elétrica por meio de algum gerador, que pode até mesmo ser uma pilha ou bateria, para que uma reação de oxirredução aconteça.
Desse modo, na matéria de hoje iremos falar tudo sobre essa reação química. Então vamos lá!
Como ocorre a Eletrólise
Para o acontecimento da eletrólise é necessário de uma fonte de energia, o que torna o processo não espontâneo.
São utilizadas, então, fontes de alimentação para que isso aconteça, como baterias, pilhas ou geradores. Essa fonte de energia é quem vai fazer com que os eletrodos funcionem. Esses eletrodos são partes essenciais para o esquema da eletrólise. Eles são, na maioria das vezes, feitos de grafita (ou grafite, composto por carbono) ou de platina.
Esses materiais servem como condutores elétricos das ondas que são enviadas por fios ligados as fontes de energia. O grafite, apesar de ser um ametal, é um ótimo condutor de energia. Sendo assim, é importante ressaltar que todo esse processo acontece em um recipiente chamado de cuba eletrolítica.
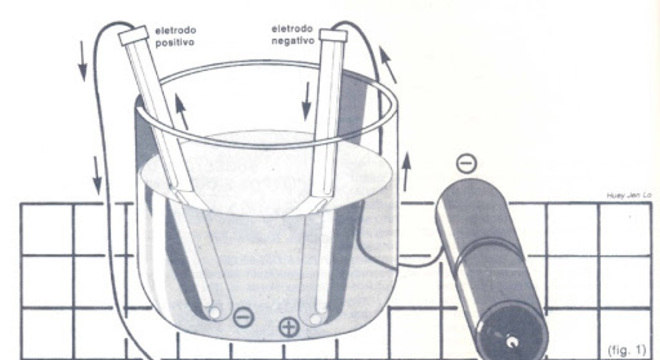
Cada um desses eletrodos é composto por um tipo de energia, uma positiva e a outra negativa. A energia positiva é chamada de ânodo ou polo positivo. Já a energia negativa é chamada de cátodo ou polo negativo.
Ao serem adicionados na cuba, os materiais são atraídos pelos eletrodos de acordo com a sua carga: positivo atrai negativo, e negativo atrai positivo.
Primeiro, são os compostos com energia positiva que se atraem ao eletrodo negativo, de onde eles retiram elétrons. Esses elétrons são enviados para o outro eletrodo, de onde a carga positiva atrai os compostos com energia negativa. Desse modo, faz surgir um fluxo de corrente de eletricidade.
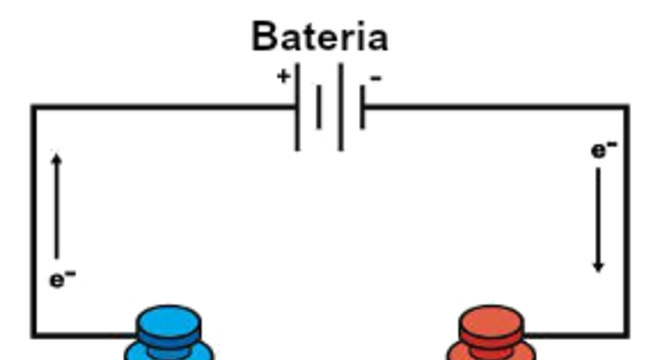
No entanto, existem dois tipos principais de eletrólise: a eletrólise ígnea e a eletrólise aquosa. Sendo assim, entenda a diferença entre elas a seguir.
Aldeído, o que é? Nomenclatura, exemplos e características
×Eletrólise Ígnea
A eletrólise ígnea é aquela que se processa a partir de um eletrólito fundido, ou seja, pelo processo de fusão.
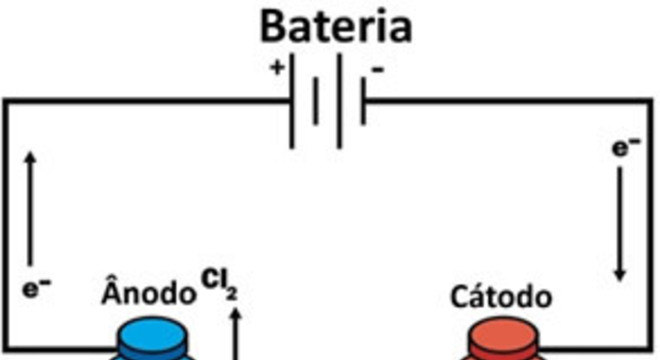
Esse tipo de reação é muito utilizado na indústria, principalmente para a produção de metais. Desse modo, veja o exemplo de eletrólise do NaCl (cloreto de sódio – sal de cozinha), com produção do sódio metálico e do gás cloro:
Semirreação no cátodo: Na++ e– → Na . (2) Semirreação no ânodo: 2 Cl–→ Cl2 + 2e– Reação global: 2 Na++ 2 Cl– → 2 Na + Cl2Sendo assim, quando a corrente elétrica passa na célula eletrolítica, os cátions de Na+ são atraídos pelo polo negativo, chamado de catodo. Já os ânions de Cl–, são atraídos pelo polo positivo, ou o ânodo.
Ou seja, no caso do Na+, ocorre uma reação de redução, enquanto no Cl–, ocorre uma reação de oxidação.
Eletrólise Aquosa
Na eletrólise aquosa, o solvente ionizante utilizado é a água. Em solução aquosa, a eletrólise pode ser realizada com eletrodos invertes ou eletrodos ativos (ou reativos).
Eletrodos InertesNesse caso, a água da solução se ioniza de acordo com a equação:
H2O

Com a dissociação do NaCl temos:
NaCl → Na+ + Cl–
Assim, os cátions H+ e Na+ podem ser descarregados no polo negativo, enquanto os ânions OH– e Cl– podem ser descarregados no polo positivo.
Nos cátions ocorrem uma reação de redução, enquanto nos ânions, uma reação de oxidação.
Assim, temos a reação de eletrólise:
2 NaCl + 2 H2O → 2 Na+ + 2 OH– + H2 + Cl2
A partir disso, podemos concluir que as moléculas de NaOH permanecem em solução, enquanto o H2 é liberado no polo negativo e o Cl2, no polo positivo.
Esse processo resultará na equação equivalente:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
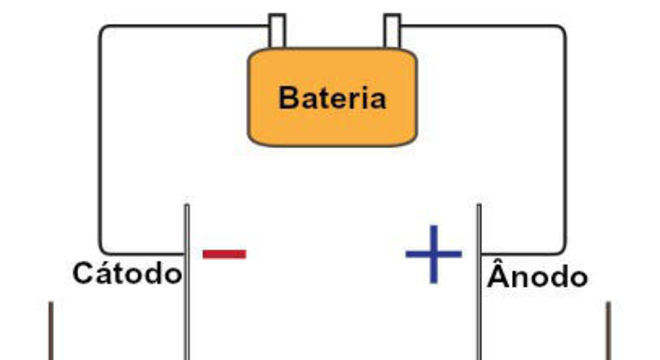
Nesse caso, os eletrodos ativos participam da eletrólise, no entanto, sofrem uma corrosão.
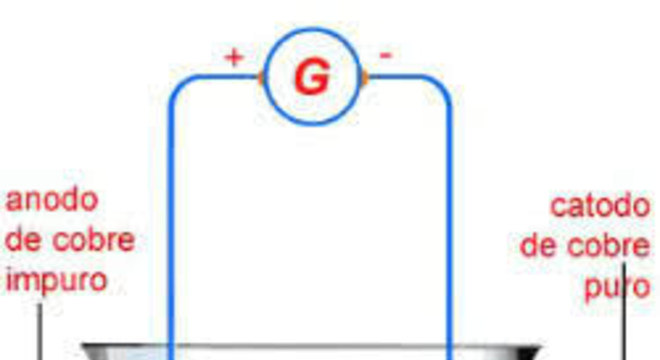
Como exemplo, temos a eletrólise em solução aquosa do sulfato de cobre (CuSO4):
CuSO4 → Cu2 + SO 2-4H2O → H+ + OH–
Sendo assim, o anodo de cobre sofrerá uma corrosão:
Cu0 → Cu2+ + 2e–
Isso ocorre pois de acordo com os potenciais-padrão dos eletrodos, a corrente elétrica tem mais facilidade em retirar os elétrons do Cu0 do que do SO 2-4 ou do OH–.
Desse modo, no polo negativo ocorre a seguinte reação de eletrólise:
2e– + Cu2+ → Cu
No entanto, no polo positivo temos a reação de eletrólise:
Cu → Cu2+ +2e–
Por fim, ao somarmos as duas equações de eletrólise temos como resultado o zero.
Leis da Eletrólise
As Leis da eletrólise foram definidas por Michael Faraday, físico-químico inglês, em 1834. De acordo com a primeira lei, a massa de qualquer elemento eletrolisado é diretamente proporcional à fração de carga que atravessa o sistema. Ou seja, se a carga elétrica que atravessa a solução for duplicada, a massa da substância também dobra.
Sendo assim: Q = i . t, onde:
Q: carga elétrica (C); i: intensidade da corrente elétrica (A); t: intervalo de tempo da passagem da corrente elétrica (s).Além disso, a segunda Lei da eletrólise define que, para uma mesma quantidade de carga elétrica, as massas das substâncias químicas eletrolisadas em qualquer eletrodo, são diretamente proporcionais aos seus equivalentes químicos.
Desse modo: M = K . E, onde:
M: massa da substância; K: constante de proporcionalidade; E: equivalente-grama da substância.
Fonte: A mente é maravilhosa
Aplicações da Eletrólise
A eletrólise é muito utilizada na indústria, pois por meio dela é possível isolar algumas substâncias fundamentais para muitos processos de produção. Além disso, também é um processo que purifica e protege (revestimento) vários metais.
Desse modo, muitos materiais e compostos químicos são produzidos a partir do processo de eletrólise, por exemplo:
Alumínio e cobre; Hidrogênio e cloro em cilindro; Bijuterias (processo de galvanização); Panela de pressão; Roda de magnésio (calotas dos carros).
Fonte: ResearchGate
Exercícios
Exercício 1(UFRGS-RS) No cátodo de uma célula de eletrólise sempre ocorre:
a) Deposição de metais.
b) Uma semirreação de redução.
c) Produção de corrente elétrica.
d) Desprendimento de gás hidrogênio.
e) Corrosão química.
Resposta: Letra B
Exercício 2(Vunesp) “Piscina sem Química” é um anúncio envolvendo tratamento de água. Sabe-se, no entanto, que o tratamento consiste na adição de cloreto de sódio na água e na passagem dessa água por um recipiente dotado de eletrodos de cobre e de platina ligados a uma bateria de chumbo de automóvel.
a) Sendo assim, com base nessas informações, discuta se a mensagem do anúncio é correta.
b) Considerando os eletrodos inertes, escrever as equações das reações envolvidas que justificam a resposta anterior.
Resposta:
a) A mensagem do anúncio não está correta, pois haverá formação de produtos químicos.
b) 2 NaCl + 2H2O → 2 NaOH + H2+ Cl2 (reação que forma o cloro, útil no tratamento da água da piscina)
2 NaOH + Cl2 → NaCl + NaClO + H2O (reação que forma o NaClO, um forte bactericida).
Exercício 3(FEI-SP) Dois alunos de Química realizaram eletrólise do BaCl2; a primeira aquosa e, a segunda, ígnea. Portanto, com relação ao resultado, podemos afirmar que ambas obtiveram:
a) H2e O2 nos ânodos.
b) H2 e Ba nos ânodos.
c) Cl2 e Ba nos eletrodos.
d) H2 nos cátodos.
e) Cl2 nos ânodos.
Resposta: Alternativa E
Desse modo, agora que você aprendeu tudo sobre eletrólise, aprenda também sobre a Lei de Faraday.
Fontes: Toda Matéria, InfoEscola, Manual de Química, Mundo Educação
Fonte Imagem Destaque: Matérias do Enem
Essa matéria Eletrólise – Como ocorre, classificação, Leis da Eletrólise e aplicações foi criada pelo site Conhecimento Científico.


![Primos fazem SEXO e causa polemica [VÍDEO COMPLETO E SEM TARJAS]](http://3.bp.blogspot.com/-vXjTwuHUrsE/Un_88dXnSrI/AAAAAAAADyM/wxGcIRXYVz4/w72-h72-p-k-no-nu/Sem+t%C3%ADtulo.jpg)



0 Comentários